这期分享的文章的标题是《界面T细胞工程 (Interfacial T cell engineering)》,它深入探讨了一个革命性的领域:如何通过在微观和纳米尺度上模拟T细胞与身体环境的“交互界面”,来更深刻地理解、控制并优化T细胞,从而为癌症、自身免疫病等重大疾病开发出更强大的细胞疗法。
引言:为什么“交互界面”对T细胞至关重要?
想象一下,T细胞是人体内一支高度专业化的“特种部队”,它们的任务是巡逻、识别并消灭入侵的病原体(如病毒、细菌)和叛变的内部细胞(如癌细胞)。要完成如此复杂的任务,T细胞不能“单打独斗”,它们必须时刻与周围的环境进行信息交换和物理互动。这种互动发生的接触点,就是科学家们所说的“界面”。
这篇文章的核心思想是:T细胞的所有关键功能——无论是巡逻、激活、增殖还是攻击敌人——都由它们在不同“界面”上的互动所决定。
细胞层面:当一个T细胞遇到一个可疑细胞时,它们会形成一个极其精密的“对接结构”,称为“免疫突触”。这就像两个航天器在太空中对接,通过这个界面,T细胞可以“审问”对方,检查其“身份证”(即抗原),并决定是激活攻击还是忽略放行。
组织层面:T细胞需要在复杂的组织(如淋巴结、肿瘤)中穿梭。它们与血管壁的界面决定了它们能否从血液中“下车”进入组织;它们与组织内部纤维结构的界面,则像是在崎岖地形中行军,决定了它们的移动速度和方向。
传统的T细胞疗法(如CAR-T),通常是在体外对T细胞进行基因改造和大量扩增,然后输回患者体内。但这些T细胞进入人体后是否能高效工作,很大程度上取决于它们能否正确地与各种界面互动。因此,如果我们能在实验室里重建并工程化这些“界面”,就不仅能揭开T细胞工作的深层奥秘,还能开发出筛选、制造和优化“超级T细胞”的全新平台。这正是本文要探讨的核心。
第一部分:T细胞的生命之旅——一部由“界面”导演的史诗
文章首先带领我们回顾了T细胞在体内的完整生命周期,强调了不同阶段中关键界面的作用。
1. T细胞的“大巡逻”:在不同组织间穿梭
一个T细胞的一生是一场永不停歇的旅程。
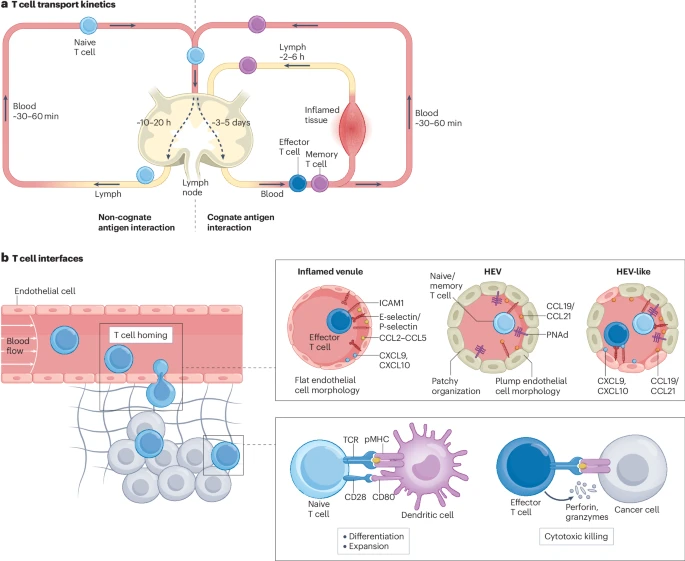
新手期(幼稚T细胞):刚“毕业”的T细胞会不断在血液、淋巴和淋巴结之间循环。这个过程就像新兵在不同的军事基地之间轮换,熟悉环境并等待任务。
- 关键界面:它们通过一种名为“高内皮微静脉 (HEV)”的特殊血管进入淋巴结。这个血管界面上布满了特殊的“路标”分子,只有新手T细胞能识别并“停靠”。这个过程耗时约10-20小时。
激活与分化:在淋巴结中,T细胞会与“情报官”——抗原呈递细胞(APC)——进行接触。如果T细胞识别到了APC呈递的“敌人信息”(抗原),它就会被激活,并在3-5天内疯狂增殖,数量可增加上万倍,同时分化成不同类型的“战士”。
- 关键界面:这就是前面提到的“免疫突触”界面,是T细胞生命中最关键的转折点。
精英期(效应/记忆T细胞):分化成熟的T细胞会离开淋巴结,进入血液,奔赴身体各处的“战场”(如被感染的组织或肿瘤)。它们现在有了新的“导航系统”,可以识别并穿过发炎组织的血管壁。
- 关键界面:发炎组织的血管壁界面会表达出不同于HEV的“紧急出口”信号,专门引导这些经验丰富的“老兵”进入战场。
2. 解密两大类关键界面
文章将T细胞遇到的界面分为组织界面和细胞界面两类。
组织界面:T细胞的“导航地图”与“地形障碍”
这指的是T细胞与更大尺度环境的互动。
血管界面:血管不仅仅是管道,更是动态的“智能高速公路”。
化学信号:血管壁上会呈现不同的化学“路标”(趋化因子),像面包屑一样引导T细胞。
物理粘附:T细胞需要先在血流中“减速、停靠、抓牢”,这依赖于一系列粘附分子的精密配合,就像船只靠岸时需要缆绳一样。
动态变化:正常情况下,只有淋巴结的血管欢迎新手T细胞。但在癌症或慢性炎症区域,普通血管也会“改造”自己,变得像淋巴结血管一样,吸引更多T细胞前来增援。
组织内部结构:当T细胞进入组织后,其内部的微观结构决定了它的行动。
淋巴结的“脚手架”:淋巴结内部有由特殊细胞构建的纤维网络,T细胞就在这个网络上爬行、扫描信息。
肿瘤的“铜墙铁壁”:实体肿瘤通常会构建致密的纤维基质,像一道道屏障,阻碍T细胞深入肿瘤核心去杀死癌细胞。这是当前T细胞疗法面临的一大挑战。
细胞界面:决定生死的“一对一”交流
这是指T细胞与其他单个细胞的直接互动。
与“情报官”APC的界面:
APC(如树突状细胞)拥有许多细长的“触手”(树突),极大地增加了与T细胞接触的表面积,使其能高效地“筛选”海量的T细胞。
T细胞表面也布满了微小的“触角”(微绒毛),上面集中了T细胞受体(TCR),用于探测APC。
当两者“情投意合”,形成的免疫突触不仅是信息交换平台,还是一个力学平台。T细胞会通过这个界面施加微小的“拉力”,这种物理力量本身就是激活信号的一部分。
与“敌人”癌细胞的界面:
激活后的杀伤性T细胞与癌细胞也会形成一个“死亡突触”。
T细胞通过这个界面,像精准的“快递员”一样,将“毒药包裹”(穿孔素和颗粒酶)递送到癌细胞表面,导致其凋亡。
有趣的是,这个过程也涉及物理力。T细胞会“挤压”癌细胞,帮助“毒药”更好地发挥作用。一些聪明的癌细胞甚至会通过“软化”自己的细胞膜来抵抗这种物理攻击,从而实现免疫逃逸。
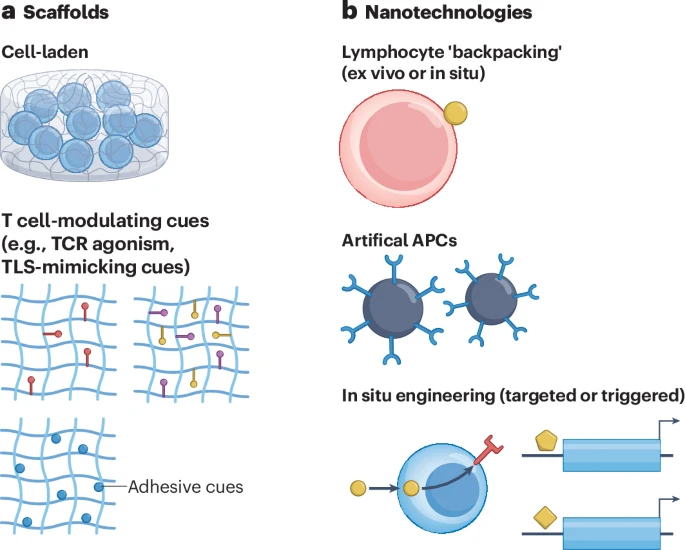
第二部分:在实验室里搭建“T细胞训练营”——界面工程技术
理解了自然界中T细胞如何与界面互动后,科学家们便开始尝试在实验室中人为地设计和制造这些界面。这就像为运动员建造专门的训练设施和模拟比赛场地。
文章详细介绍了多种用于此目的的“微纳技术”。 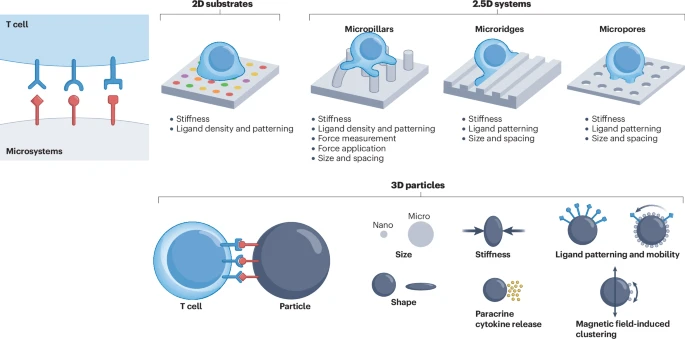
1. 模拟“细胞界面”的技术
这些技术旨在模拟T细胞与单个细胞(如APC或癌细胞)的互动。
2D和2.5D平面系统:
智能培养皿:科学家们可以在培养皿表面制作出不同硬度的凝胶,发现T细胞在特定硬度(约100 kPa)的表面上激活效果最好。这证明了T细胞能“感知”环境的物理硬度。
微图案表面:利用微加工技术,可以在表面上用激活T细胞的分子“画”出各种微米级的图案。研究发现,将激活信号集中成一个“岛”,周围环绕着粘附信号,T细胞的激活效率最高。
微柱阵列:就像一个钉床,T细胞可以在这些微小的柱子之间运动。这些柱子可以被设计得非常灵敏,能实时测量T细胞施加的微小力量,从而揭示其背后的力学机制。
3D颗粒系统(人工APC):
这是目前应用最广泛的技术之一,即制造出细胞大小的微球,在其表面覆盖上激活T细胞所需的信号分子,来模仿APC。这些“人工APC”是体外扩增T细胞的“标准陪练”。
尺寸和硬度的影响:研究发现,尺寸较大(>4微米)、硬度适中的微球,其激活T细胞的效果更好。商业上著名的Dynabeads就是这类产品的代表。
形状和材料的创新:科学家们还开发了椭球形、纳米管状等不同形状的“人工APC”,发现各有利弊。例如,可降解材料(如PLGA)制成的微球,还能包裹并缓慢释放促进T细胞生长的细胞因子,实现“陪练”与“喂饭”一体化。
磁性控制:在微球中加入磁性纳米颗粒,就可以通过外部磁场来控制微球的聚集或运动,实现对T细胞的远程、动态刺激,这为精准调控提供了新的可能。
2. 模拟“组织界面”的技术
这些技术旨在模拟T细胞在复杂组织(如血管、肿瘤)中的迁移和浸润过程。
微流控芯片:构建“人造血管”和“人造组织”
模拟血管 homing(归巢):可以在微小的通道中模拟血液流动,通道内壁可以覆盖内皮细胞或特定的粘附分子,用来研究T细胞如何在血流中“刹车”并粘附到血管壁上。
筛选“最强T细胞”:利用这种芯片,可以变成一个“T细胞选拔赛道”。将患者的T细胞注入芯片,那些能最有效地粘附和迁移的细胞会被“筛选”出来。研究证明,通过这种方式筛选出的T细胞,输回小鼠体内后,其进入肿瘤的能力确实更强。
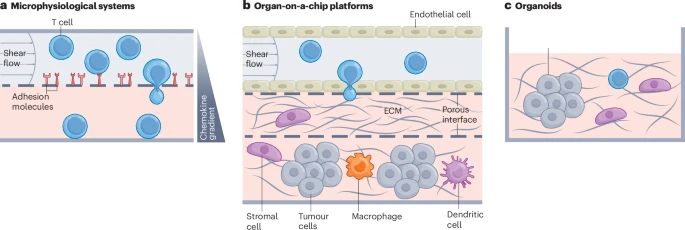
模拟完整入侵过程:更高级的芯片可以整合多个模块,构建出一个“肿瘤-血管-芯片”模型。它包含模拟的血管通道、内皮细胞层、以及填充了癌细胞和纤维基质的“肿瘤室”。科学家可以完整地观察到T细胞如何从“血管”中穿出,穿越“组织”,最终找到并杀死“癌细胞”的全过程。这种“芯片上的器官”技术,为药物筛选和个性化治疗评估提供了前所未有的强大工具。
类器官 (Organoids)
这是一种更接近真实器官的3D细胞培养技术。通过培养从患者肿瘤中取出的细胞,可以在培养皿中长出微小的“肿瘤类器官”。
将患者自己的T细胞与他自己的“肿瘤类器官”共培养,可以直接观察T细胞的杀伤效果,为患者“量身定制”最有效的T细胞疗法。
第三部分:从实验室走向临床——在体内直接进行界面工程
最终的目标,是将在实验室学到的知识应用到患者体内,直接对T细胞进行调控。 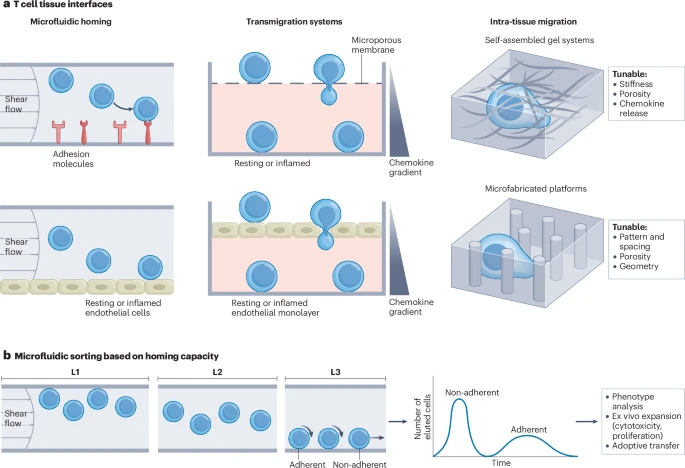
1. 植入式“T细胞大本营”——生物材料支架
可以设计一种可降解的生物材料支架,像一块小海绵,将其植入体内(例如,在肿瘤切除术后的位置)。
这个支架可以预先装载好T细胞,为其提供一个安全的“庇护所”和生存环境。
或者,支架可以装载吸引和激活T细胞的信号分子,在体内创建一个“人造淋巴结”,吸引患者自身的T细胞前来,并在局部进行“训练”和扩增,从而对残留的癌细胞发起攻击。
2. 纳米技术:“T细胞背包”与“基因快递”
纳米背包:可以将携带药物(如细胞因子)的纳米颗粒,像“背包”一样挂在T细胞表面。当T细胞到达肿瘤后,这些“背包”可以缓慢释放药物,为T细胞“加油鼓劲”,增强其战斗的持久力。
体内基因编辑:设计能够精准靶向T细胞的纳米载体,将编码CAR的基因指令直接“快递”给体内的T细胞,实现“原位CAR-T细胞制造”。这将大大简化治疗流程,缩短等待时间,降低成本。
远程遥控:更具科幻色彩的是,可以利用光、热或超声波等外部信号,来远程“开启”或“关闭”T细胞的功能。例如,设计一种只有在特定光照下才会被激活的CAR-T细胞,这样医生就可以精准控制T细胞只在肿瘤区域内发挥作用,避免伤害正常组织。
结论与展望:界面工程引领T细胞疗法的未来
文章最后总结道,“界面工程”为T细胞研究和治疗开辟了一个全新的维度。未来的发展方向包括:
更逼真的模拟平台:需要构建更复杂的体外模型,不仅包含癌细胞和T细胞,还要加入免疫系统中的其他调节细胞(如调节性T细胞、巨噬细胞等),并模拟肿瘤组织的动态变化,以更全面地理解免疫反应。
革新T细胞制造工艺:将基于界面工程的筛选和质控平台,整合到CAR-T细胞的自动化生产流程中。我们不仅要看T细胞的数量,更要评估它们的“功能质量”,如归巢能力、浸润能力和杀伤持久性,从而制造出真正的“精英T细胞”。
迈向智能体内调控:未来的终极目标是在体内实现对T细胞的闭环、智能化调控。通过合成生物学工具和先进的生物材料,我们或许能构建出能感知体内环境、并按需产生T细胞的“人造免疫器官”,或者开发出能被小分子药物精确控制开关的“智能CAR-T细胞”。
总而言之,这篇论文描绘了一幅激动人心的蓝图:通过成为T细胞微观世界的“建筑师”和“工程师”,我们可以解锁下一代免疫疗法的巨大潜力,为战胜癌症和其他顽固疾病带来新的曙光。